Initialement, des études de microscopie classique bidimensionnelle (2D) ont été réalisées pour décrire la formation de l’union du greffon/porte-greffe. Cependant, la mise en place de ces tissus et notamment l’établissement des jonctions vasculaires se fait dans les 3 dimensions et l’analyse en 2D rend difficile la compréhension des évènements. Afin de pallier ce manque d’information, des techniques d’imagerie 3D ont été développées sur vigne depuis quelques années (Brodersen et al, 2011 ; Milien et al, 2012 ; Wason et al, 2017).
D’usage courant dans le domaine médical pour identifier certaines pathologies, la tomographie à rayons X s’est aussi développée dans d’autres domaines dont la biologie végétale en raison de sa capacité à imager les structures en profondeur et à fournir des images qui peuvent être reconstruites en 3D. Cette technique fournit des informations sur l’architecture tissulaire en relation avec la densité des tissus aux rayons X. De précédents travaux sur vigne ont ainsi pu montrer son intérêt pour mettre en évidence le bois, les vaisseaux, et les tissus nécrosés.
1- Le projet ORIGINE a contribué à la mise au point des outils d’imagerie et notamment la tomographie à rayons-X (microCT) et des méthodes spécifiques d’analyse d’image applicables sur la vigne.
La figure 1 montre la plateforme utilisée et, la figure 2, les différents types d’images que l’on peut obtenir.

Figure 1 : Tomographe utilisé pour cette étude situé à Montpellier RIO Imaging Center (Montpellier, France)
En microtomographie à rayons-X (=Tomo-RX), les images obtenues sortent en niveaux de gris selon la densité des tissus comme on peut l’observer sur des radiographies chez l’homme. Les tissus denses aux rayons apparaissent en gris clair ou blancs (bois, grains de sable mais aussi la sève…) à l’inverse des tissus peu denses l’air ou les tissus dégradés qui apparaissent en gris foncé ou en noir (Figure 2a). Il est à noter que les vaisseaux remplis d’eau (denses aux rayons X) se confondent avec les autres tissus voisins de même densité, et sont ainsi peu visibles contrairement aux vaisseaux remplis d’air qui apparaissent en noir (Figure 2b).
Les images obtenues sont ensuite reconstruites en volume ce qui permet de se déplacer virtuellement dans l’objet obtenu et de l’observer dans les différents plans d’intérêt. On peut ainsi réaliser des coupes virtuelles longitudinales (figure 2a) ou transversales (figure 2b).
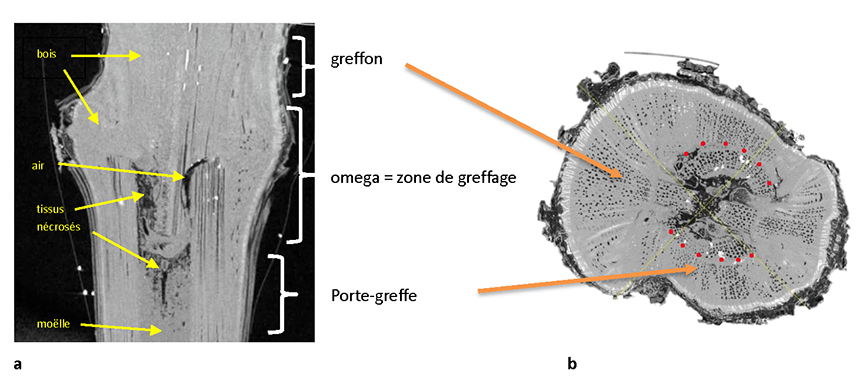
Figure 2 : Exemple d’images extraites après reconstruction en 3D en coupe longitudinale (a) ou transversale dans l’Omega (b). On met bien en évidence la forme de l’omega (a), les 2 partenaires (greffon et porte-greffe) et en « coupe » transversale les cernes du bois, et les vaisseaux remplis d’air.
On identifie les principaux tissus (moelle, bois, phloème), et on peut aussi visualiser de façon plus fine les vaisseaux vides et remplis ainsi que les cernes dans le bois correspondant ici au bois présent avant le greffage du bois et au bois produit l’année de pépinière (limite indiquée par les pointillés rouges).
En vidéo : Tomographie d’un jeune plant de vigne greffé en Omega
 Cette vidéo montre l’intérêt de la visualisation en 3D pour étudier cette zone très complexe. Elle a été obtenue par Tomographie au Rayon X d’un jeune plant de vigne greffé en Omega et dévoilant l’organisation interne au niveau de la soudure. Voir la vidéo
Cette vidéo montre l’intérêt de la visualisation en 3D pour étudier cette zone très complexe. Elle a été obtenue par Tomographie au Rayon X d’un jeune plant de vigne greffé en Omega et dévoilant l’organisation interne au niveau de la soudure. Voir la vidéo
2- Les observations préliminaires faites sur des vignes greffées qui passent ou non les critères de tri et notamment le test de la soudure ont permis de définir quelques indicateurs d’intérêt.
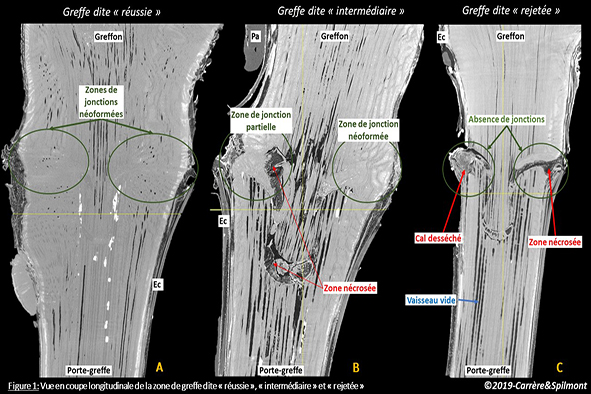
Sur la figure 3, deux jeunes greffés-soudés sont analysés en sortie de pépinière : un plant qui passe (A) et un plan qui ne passe pas (B) le test de la soudure.
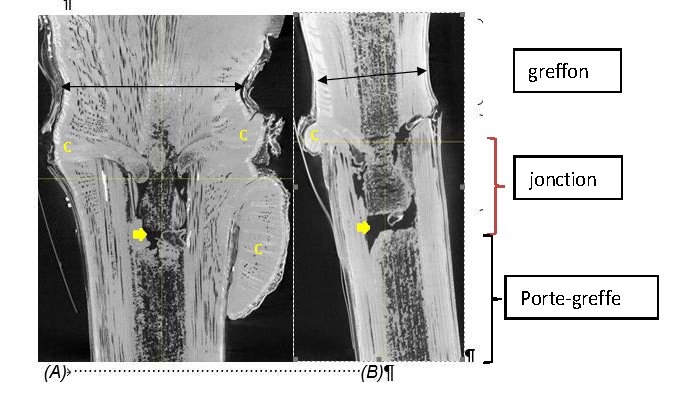
Figure 3: : Coupe longitudinale virtuelle d’une zone de greffe obtenue en Tomographie à rayons X après reconstruction en 3D. Comparaison entre un plant qui passe le tri (A) et un plant éliminé après le test de la soudure (B). Les zones sombres sont peu denses aux rayons X : c’est notamment le cas des zones « de nécroses et air » visibles au niveau de la jonction sur les deux plantes.
On identifie facilement la zone de greffe en omega. Le cal (c) formé par les deux partenaires apparait en gris clair. Il est présent à la fois en interne à la jonction des deux partenaires et en externe. Dans le cas de la bonne greffe, il a rempli la quasi-totalité de l’espace entre le greffon et le porte-greffe.
Des différences sont visibles au niveau de la jonction sur ces 2 greffés-soudés. On observe notamment dans la vigne éliminée (B : soudure cassée après le test du pouce) plus « d’air et de nécrose » dans la soudure et un volume de bois réduit qui se traduit par un diamètre du greffon plus fin.
3- Pour voir si ces critères internes étaient intéressants, ces analyses ont été appliquées à des effectifs de greffés-soudés plus conséquents et des outils d’analyse spécifiques ont été développés.
Deux combinaisons greffon/porte-greffe (Merlot/SO4 et Ugni blanc /RSB1) avec différents degrés de réussite au greffage (produisant différents pourcentages de plantes commercialisables après un an en pépinière) ont été utilisées dans cette étude. 200 plants ont été greffés en oméga pour chaque lot. 60 à 80 plants ont été sélectionnés au hasard dans ces deux combinaisons après arrachage de la pépinière pour être analysés. Ces plants ont été décrits sur tout un panel de critères externes puis scannés par microtomographie RX et enfin testés au niveau de la soudure.
Des outils spécifiques d’analyse d’image ont été développés pour mesurer notamment i) le volume des différents tissus dans le greffon et dans le porte-greffe et ii) le volume de « nécrose + air » dans la zone de jonction et ainsi quantifier un certain nombre d’indicateurs qui semblaient intéressants (Spilmont et al, Enoforum).
Ces outils nous ont permis de réaliser des mesures in situ de volumes de moelle, de bois initial et de bois néoformé (= bois produit après la greffe) dans le greffon et le porte-greffe et de calculer le volume du vide dans la zone de jonction ainsi que sa répartition dans l’ensemble des greffés soudés analysés et testés au moment du tri.
Le premier critère identifié correspond à la quantité de bois formé post-greffage. Ce bois correspond au deuxième cerne de xylème visible sur la figure 4. Les mesures sont réalisées dans le greffon et dans le porte-greffe. La production de bois formé post greffage est un indicateur du fonctionnement de la plante.
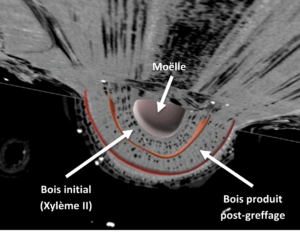
Figure 4 : vue « orthoslice » d’un plant mettant en évidence les 2 cernes de bois
Quantité de bois produit dans le greffon dans les lots testés
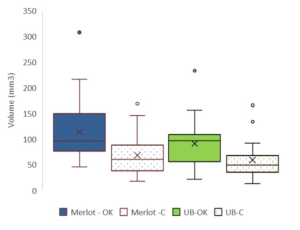
Figure 5 : Quantité de bois formé post-greffage dans le greffon dans les différentes catégories de greffés-soudés des 2 lots analysés (Merlot/SO4 et Ugni Blanc/RSB1). Plantes passant (OK= passent) ou pas le test de la soudure (C= cassent)
On voit nettement dans la figure 5 que la quantité de bois produite après greffage dans le greffon (merlot ou ugni blanc) est plus importante chez les plantes qui passent le test de la soudure et ce, pour les deux combinaisons étudiées. Cette différence est statistique et ce critère pourrait donc être discriminant de la qualité des plants.
Le second critère analysé concerne la proportion de « vide et de nécroses » dans la zone de jonction (= omega)
On voit dans la figure 6a (à gauche), la zone de jonction de l’Omega en 3D dans un jeune plant greffé-soudé : elle est représentée en jaune. La tomographie permettant d’identifier des zones de densités différentes, il est possible de les visualiser dans cette zone de jonction les volumes moins denses correspondants à des vides ou des nécroses. Ces zones sont représentées en rouge dans la figure 6b (à droite).
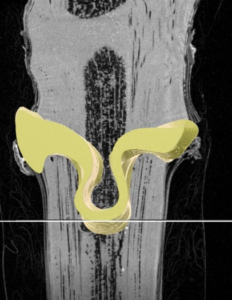
Figure 6a : En jaune, zone de jonction en 3D correspondant aux tissus produits par les 2 partenaires après la greffe. La forme en omega est bien reconnaissable. Analyse réalisée sur un greffé-soudé (représenté en CL) au moment du tri.
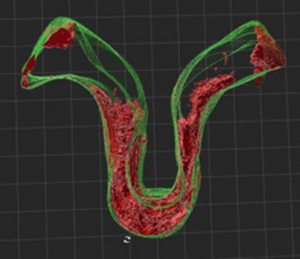
Figure 6b : zone de jonction représentée en deux couleurs. Les tissus peu denses correspondants aux tissus nécrotiques et à l’air apparaissent en violet (ou rouge) ; ils sont notamment présents en bas de l’omega. Les zones en transparence correspondent à des tissus denses comme le bois.
Une fois cet outil développé et validé, il a été appliqué sur les de mêmes lots de greffés-soudés. Les résultats sont présentés dans la figure 7 (ci-dessous).
Proportion d’air et nécroses dans les lots testés
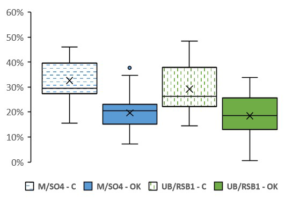
Figure 7 : Quantité de « nécroses et d’air » dans la zone de jonction dans les plantes passant (OK= passent) ou pas le test de la soudure (C= cassent) : résultats obtenus sur les 2 lots analysés (Merlot/SO4 et Ugni Blanc/RSB1).
Les 2 combinaisons se comportent de la même façon. Pour chaque lot analysé, nous pouvons observer une différence marquée entre les vignes qui passent ou pas le test du pouce avec en moyenne respectivement 20% « d’air + nécroses » contre 30% d’air + nécroses dans les secondes. Ces différences sont statistiques et les plants qui ne cassent pas ont donc significativement moins « d’air et de nécrose » dans la zone de jonction. Ce résultat paraît tout à fait logique mais n’avait jamais pu être observé et encore moins démontré. En dépit d’une certaine hétérogénéité, cette différence entre plantes « qui cassent » ou « ne cassent pas » est suffisamment marquée pour envisager de fixer un seuil pour les séparer (ici à 25%). Ce critère pourrait, à moyen ou long terme, présenter un intérêt en vue d’aider au tri des plants en complément ou en remplacement du test physique de la soudure.
Ces deux indicateurs sont les plus intéressants identifiés à cette date mais de nombreux autres résultats ont été obtenus qui concernent à la fois des critères externes (Carrere et al, 2022) et internes et nous permettent d’envisager différentes perspectives d’application.
Conclusions et perspectives
Nous avons donc développé, puis évalué, une méthodologie spécifique associant de la tomographie-RX et de l’analyse d’images en 3D qui a permis de caractériser plus précisément ce qui distingue les greffés-soudés qui passent de ceux qui ne passent pas le tri à l’arrachage de la pépinière.
Ceci nous a permis d’identifier deux critères internes corrélés au test de la soudure. Il ‘agit d’une part de la quantité de bois formé après greffage et d’autre part de la proportion « air + tissus nécrosés» dans la zone de jonction. L’identification de ces indicateurs ouvre la voie, à moyen ou long terme, à de nouveaux outils d’aide au tri de greffés-soudés de qualité.
La tomographie à rayons X et d’autres méthodes d’imagerie (IRM, RMN…), peuvent, en tant qu’outils non destructifs, fournir des informations très importantes pour aider à décrypter les événements complexes du processus de greffage. Ces nouvelles approches aideront les pépiniéristes à répondre aux nombreuses questions qu’ils se posent (impact des process de stratification, incompatibilités, types de greffes…) afin de les aider à sélectionner des plants de qualité pour les viticulteurs.
Cet article a été rédigé par Anne-Sophie Spilmont, Camille Carrere, Yosra Hmedi et Guillaume Mathieu, Institut Français de la Vigne et du vin (IFV), Montpellier, France.
Contact : Anne-Sophie Spilmont
Références
Brodersen CR, Lee EF, Choat B, Jansen S, Phillips RJ, Shackel KA, McElrone AJ & Matthews MA. (2011). Automated analysis of three‐dimensional xylem networks using high‐resolution computed tomography. New Phytologist 191: 1168– 1179.
Milien M., Renault-Spilmont A. S., Cookson S. J., Sarrazin A. & Verdeil J. L. (2012). Visualization of the 3D structure of the graft union of grapevine using X-ray tomography. Scientia Horticulturae 144: 130-140. 10.1016/j.scientia.2012.06.045.
Wason JW, Huggett BA, Brodersen CR. (2017). MicroCT imaging as a tool to study vessel endings in situ. Am. J. Bot. 104: 1424–1430. https://doi.org/10.3732/ajb.1700199.
Pour en savoir plus
Spilmont, A.-S. and C. Carrere (2019). Origine : fiche Technique n°1, PNDV.
Spilmont, A. S., et al. (2021). Utilisation de la tomographie à rayons X pour comprendre la formation de l’union greffon/porte-greffe chez la vigne. Le pépiniériste. 240: 49-51.
Spilmont, A.-S., et al. (2021). X-ray tomography: A promising tool to assess the selection of good quality grafted vines prior to their commercialization. Enoforum.
Revue des Oenologues
Loupit G, Cookson SJ. (2020). Identifying Molecular Markers of Successful Graft Union Formation and Compatibility. Frontiers in Plant Science 11.
Loupit G, et al. (2022). Identifying early metabolite markers of successful graft union formation in grapevine Horticultural Research 9, uhab070.
Carrere, C., et al. (2022). Evaluation of criteria to assist the selection of good quality grafted grapevines prior to their commercialisation. OENO One 56(2): 15-27.
ster’s plant propagation: principles and practices. Upper Saddle River, NJ: Prentice Hall, 411-460.
Loupit G, Cookson SJ. 2020. Identifying Molecular Markers of Successful Graft Union Formation and Compatibility. Frontiers in Plant Science 11.
Loupit G, Prigent S, Prodhomme D, Spilmont AS, Hilbert G, Franc C, de Revel G, Ollat N, Valls Fonayet J, Cookson SJ. 2022. Identifying early metabolite markers of successful graft union formation in grapevine Horticultural Research 9, uhab070.

- Performance Pulvé - 24 avril 2024
- Comment suivre le risque gel ? - 3 avril 2024
- Enquête mildiou 2023 – Occitanie Bassin Sud-Ouest - 29 mars 2024
- Webinaire Oper-8 - 27 mars 2024
- Observatoire de l’inoculum aérien des maladies cryptogamiques de la vigne en Nouvelle-Aquitaine : bilan de la campagne 2023 et perspectives - 15 mars 2024
- Découvrez l’impact environnemental du désherbage alternatif - 6 mars 2024
- SIA : les avancées des actions face au changement climatique - 28 février 2024
- AppEAU renseigne les conseillers viticoles sur l’état hydrique des parcelles de leurs clients - 22 février 2024
- Le coût économique de Cryptoblabes gniediella - 14 février 2024
- Gestion de la disponibilité du cuivre dans les sols viticoles - 6 février 2024



Réagir à l'article
Pour pouvoir laisser un commentaire, vous devez être inscrit sur notre site.
M'inscrireL'inscription est gratuite.
Déjà inscrit
Lost your password?