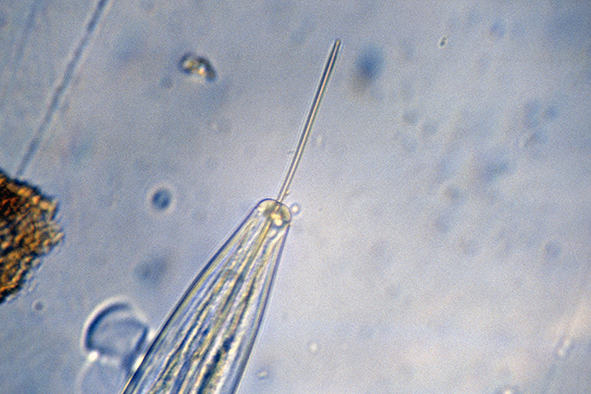
virus du court noué (Xiphinema index) photo prise au microscope
Les virus sont des parasites obligatoires qui ont besoin d’un hôte pour se multiplier. Ils peuvent avoir des effets néfastes voire mortels sur les plantes. Ces agents pathogènes sont présents dans les bois et peuvent être transmis par des vecteurs (insectes, nématodes..). Aucun traitement curatif n’est possible et, la seule méthode de lutte consiste à arracher les plants atteints et à éliminer les vecteurs pour éviter la contamination des autres plants.
Chez la vigne, plus de 80 virus ont été identifiés à cette date mais fort heureusement, seuls quelques-uns ont des impacts importants. La sélection sanitaire et la certification ont pour objectif de prévenir la diffusion de ces viroses.
Certification : que dit la réglementation ?
L’absence de virus graves dans les plants de vignes est essentielle pour la filière vitivinicole. En France, le processus de certification offre aux viticulteurs la garantie de plants de vigne indemnes des viroses graves que sont le court-noué et l’enroulement. Dans ce cadre, la réglementation impose aux professionnels de la filière de la pépinière viticole de réaliser des autocontrôles sanitaires de leurs parcs de vignes mères, selon des fréquences spécifiques. Il existe ainsi une obligation de contrôle des vignes-mères vis-à-vis des virus du court-noué (Figure 1) et des enroulements 1 et 3.
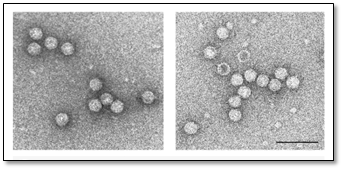
Figure 1 : Vue en microscopie électronique des virus du court-noué (GFLV à gauche et ArMV à droite). D’après P. Schellenberger, 2010
Par ailleurs certains pays imposent de réaliser des tests virologiques sur le matériel végétal destiné à l’export. Le recours à différentes méthodes de détection permet de connaitre l’état sanitaire des plants et des souches.
Quelle méthode de détection choisir ?
Différentes méthodes existent pour rechercher des virus dans des échantillons de bois, feuilles ou racines. La plus courante est le test ELISA mais des méthodes plus récentes comme la RT-PCR sont maintenant disponibles.
Le test ELISA : un test antigénique
Le test ELISA est basé sur la réaction anticorps-antigène. Des anticorps spécifiques sont utilisés contre des protéines présentes à la surface du virus (=antigènes) et composant la capside protéique (Figure 2).
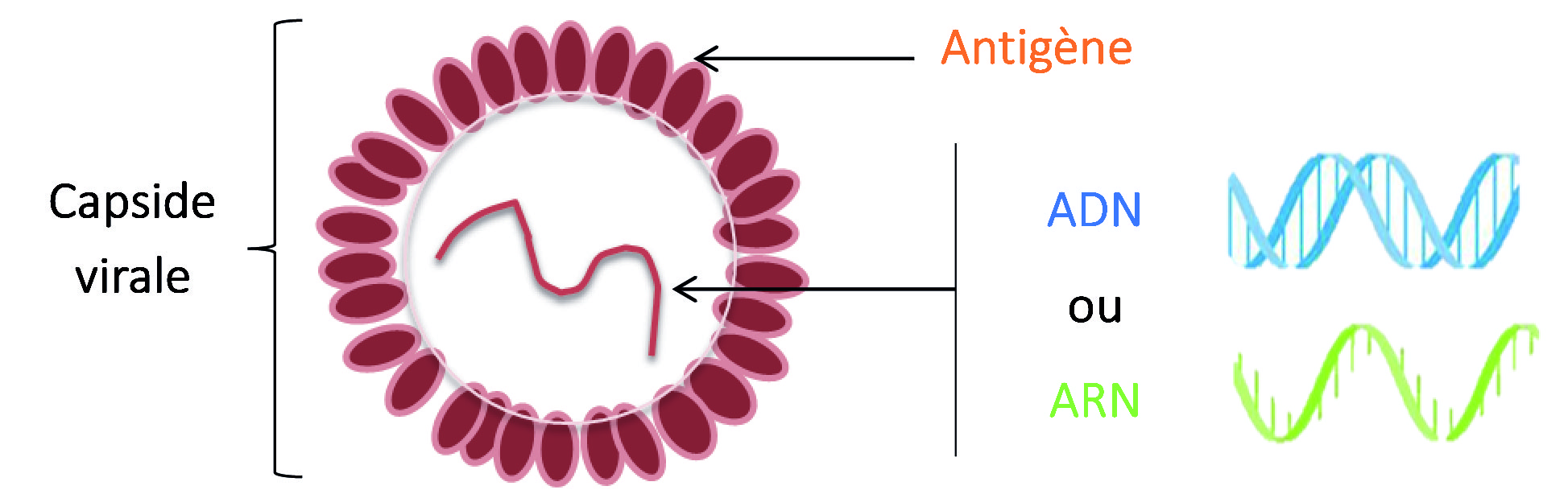
Figure 2 : schéma d’un virus comprenant un acide nucléique entouré d’une capside protéique
La détection se déroule sur 2 jours en incluant différentes étapes d’incubation et de lavages à des températures spécifiques. La coloration jaune d’un puits traduit la présence dans l’échantillon du virus recherché. Les analyses sont réalisées dans des plaques comprenant 96 puits (Figure 3A). La lecture des tests est ensuite réalisée à l’aide d’un spectrophotomètre qui va traduire l’intensité de la coloration en valeur (Figure 3B). Ces valeurs sont comparées avec celles obtenues sur des échantillons témoins dont l’état sanitaire est connu.
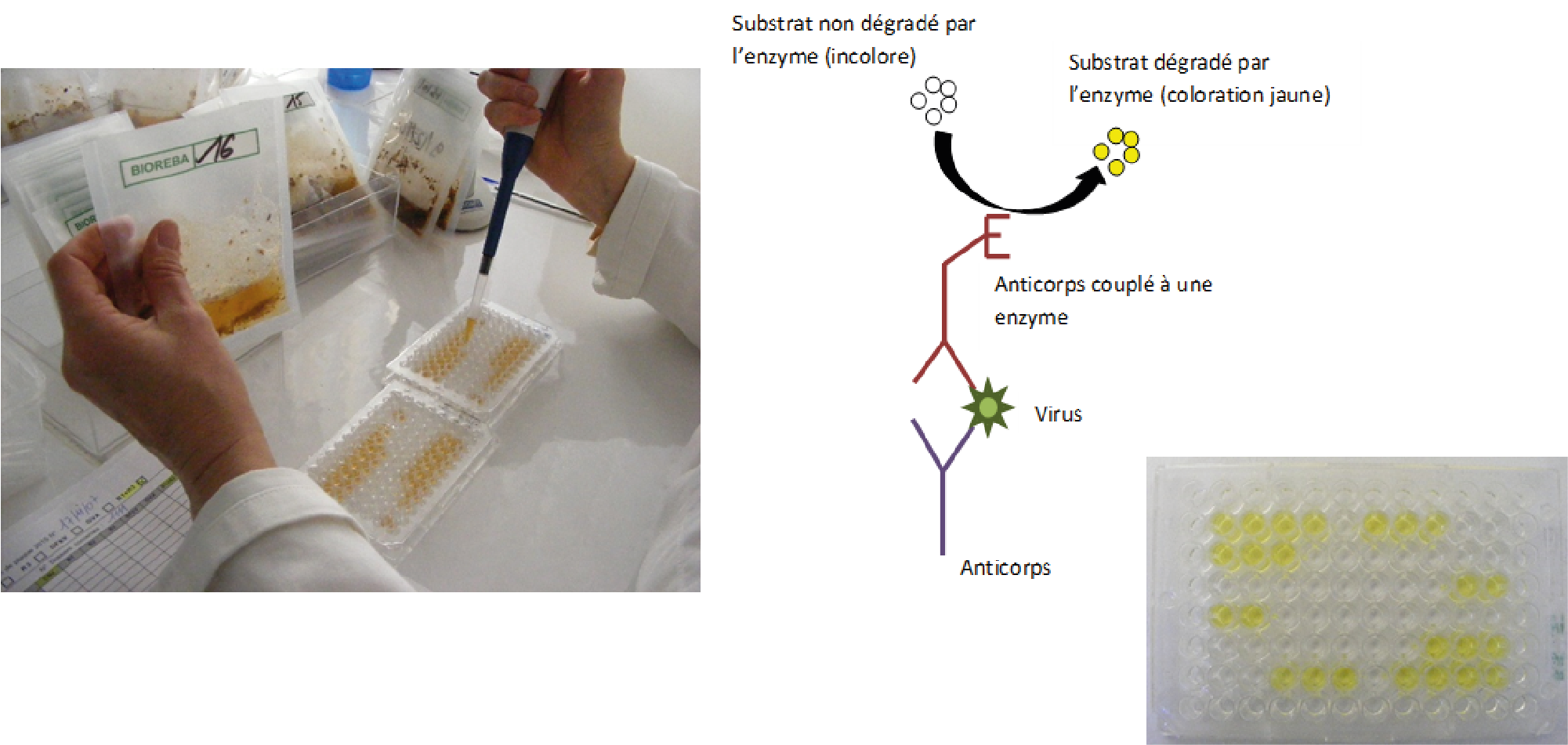
Figure 3 : Méthode Elisa
A : Dépôt des broyats d’échantillons dans la plaque.
B : Révélation de la plaque avant lecture : schéma et photo d’une plaque. Les puits jaunes correspondent à des échantillons positifs
Cette méthode rapide permet de traiter un grand nombre d’échantillons. L’ensemble des virus peuvent être détectés par cette méthode sur bois et, sur feuilles selon la période et le virus recherché. Des tests peuvent aussi être réalisés sur racines de greffés-soudés.
C’est la méthode officielle pour le suivi des vignes-mères de greffons et de porte-greffes
PCR, RT-PCR ou Q-PCR : qu’est-ce que c’est ?
Ce sont toutes des méthodes moléculaires basées sur la capacité d’une enzyme spécifique à multiplier des séquences d’ADN lors de réactions en chaine successives. Cette enzyme, dénommée polymérase a donné son nom au terme anglais « PCR » pour « Polymerase Chain Réaction ».
La PCR va permettre d’amplifier une séquence d’ADN spécifique alors que la RT-PCR va, grâce à une étape supplémentaire permettre d’amplifier une séquence d’ARN. On parlera de PCR quand la détection de l’ADN amplifié se fera par visualisation d’une bande à la taille attendue sur gel (figure 4B) ou de Q-PCR (ou PCR en temps réel) quand la détection se basera sur l’analyse de courbes correspondant à des émissions de fluorescence (figure 4C).
Dans le cas de son application à la détection de virus, cette méthode va donc chercher à détecter cette fois-ci une séquence spécifique d‘ARN ou l’ADN (1) du virus recherché. Après broyage de l’échantillon dans un tampon spécifique pour libérer l’ARN viral, on réalise une extraction et une amplification en présence d’amorces spécifiques du virus grâce à l’enzyme. Après dépôt sur gel, la présence d’une bande à la taille attendue confirme la présence du virus recherché dans l’échantillon (Figure 4A, PCR).
Cette méthode, plus sensible que le test ELISA, permet aussi de rechercher un plus grand panel de virus. Cette méthode est néanmoins plus complexe à mettre en place sur des grandes quantités d’échantillons. Elle est aussi plus onéreuse. Étant donné sa plus grande sensibilité par rapport aux tests ELISA, elle peut être utilisée toute l’année sur bois ou feuilles (sauf aux périodes très chaudes) pour détecter la quasi-totalité des virus de vigne.
Dans le cas de la sélection sanitaire, elle est utilisée en amont pour l’agrément des clones en complément de l’indexage et des tests ELISA avant toute diffusion du matériel initial. Elle peut être aussi utilisée pour vérifier l’état sanitaire de plants présentant ou pas des symptômes.
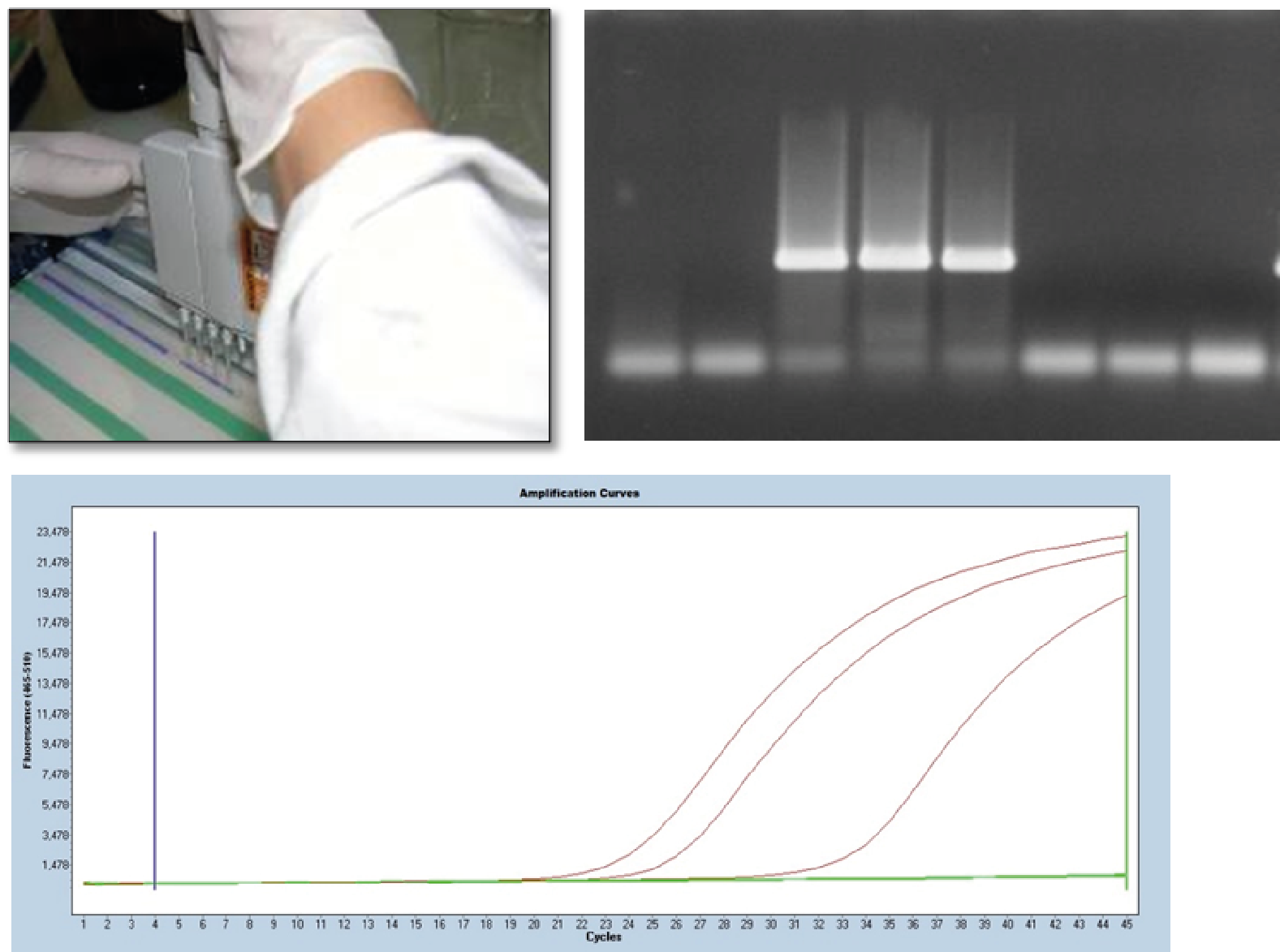
Figure 4 : Méthodes PCR et Q-PCR
PCR : Dépôt des extraits d’ADN dans le gel pour la révélation post amplification (A) et zoom sur une partie du gel (B).
Q-PCR : Courbes de fluorescence obtenues lors de l’amplification (‘C) : les 3 courbes rouges correspondent à des échantillons infectés et les courbes vertes à des échantillons négatifs
Bon à savoir
Le laboratoire du Pôle National Matériel Végétal de l’IFV est accrédité COFRAC (pour plus de précisions consulter le site www.cofrac.fr) et agréé par DGAL pour réaliser les autocontrôles des vignes-mères par test ELISA.
(1) Les virus les plus fréquents sur vigne étant des virus à ARN, on recourt pour ceux-ci à la RT-PCR qui avec une étape supplémentaire permet d’obtenir de l’ADN à partir de l’ARN viral
Article rédigé par Anne-Sophie Spilmont et Christophe Séréno, IFV Pôle Matériel Végétal
.
- Performance Pulvé - 24 avril 2024
- Comment suivre le risque gel ? - 3 avril 2024
- Enquête mildiou 2023 – Occitanie Bassin Sud-Ouest - 29 mars 2024
- Webinaire Oper-8 - 27 mars 2024
- Observatoire de l’inoculum aérien des maladies cryptogamiques de la vigne en Nouvelle-Aquitaine : bilan de la campagne 2023 et perspectives - 15 mars 2024
- Découvrez l’impact environnemental du désherbage alternatif - 6 mars 2024
- SIA : les avancées des actions face au changement climatique - 28 février 2024
- AppEAU renseigne les conseillers viticoles sur l’état hydrique des parcelles de leurs clients - 22 février 2024
- Le coût économique de Cryptoblabes gniediella - 14 février 2024
- Gestion de la disponibilité du cuivre dans les sols viticoles - 6 février 2024






Réagir à l'article
Pour pouvoir laisser un commentaire, vous devez être inscrit sur notre site.
M'inscrireL'inscription est gratuite.
Déjà inscrit
Lost your password?